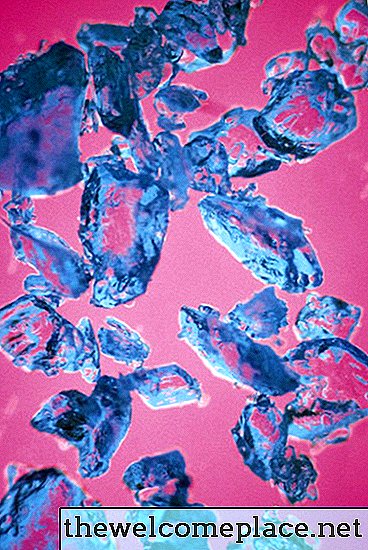
많은 전이 금속 착물과 마찬가지로, 황산구리 (II) 5 수화물은 밝은 색을 띠고; 이 아름다운 물질의 결정은 옅은 파란색 음영입니다. 그것의 색은 그것의 구성의 화학과 물리학, 또는 더 구체적으로, 구리에 부착 된 황산염 이온과 물 분자와의 결합의 종류에서 유래합니다.
 황산구리 오수화물은 아름다운 반투명 청색을 has니다.
황산구리 오수화물은 아름다운 반투명 청색을 has니다.궤도
전자는 파동-입자 이중성을 나타내며, 이는 파동-유사 특성과 입자-유사 특성을 모두 가지고 있음을 의미합니다. 원자에서 전자의 거동은 파동 함수 라 불리는 파동 형 방정식으로 설명됩니다. 파동 함수의 제곱은 주어진 시간에 특정 지점에서 전자가 발견 될 확률을 제공합니다. 원자에서 전자의 파동 함수는 원자 궤도라고도합니다. 화학자들은 궤도의 에너지 레벨을 지정하기 위해 숫자를 사용하고 궤도의 유형을 지정하는 문자를 사용하여 원자 궤도를 명명합니다. 주기율표의 4 번째주기 이상에있는 원소의 경우, 세 가지 유형의 궤도, 즉 s, p 및 d에만 중점을두면됩니다. 이 궤도의 모양에 대한 느낌을 얻으려면 리소스 섹션의 링크를 참조하십시오.
크리스탈 필드 분할
황산구리 (II)의 구리 이온은 두 개의 전자를 잃어 버렸으므로 +2 전하를 갖습니다. 가장 바깥 에너지 레벨 또는 껍질에 9 개의 전자가있다. 이들 소위 원자가 전자는 모두 3 차원 궤도를 차지한다. 물 분자와 황산 이온은 구리 이온의 양전하로 끌어 당겨져 팔면체 형태로 접근하여 주위에 배열합니다. 결과적으로, 구리 이온의 5 개의 3 차원 궤도 중 2 개는 황산염 이온과 물 분자가 접근하는 축을 따라 정렬됩니다. 이들 오비탈의 전자와 분자 / 이온의 전자는 모두 음전하를 띠기 때문에 서로 격퇴한다. 결국, 5 개의 3D 궤도 중 2 개는 에너지를 증가 시켰습니다. 이를 궤도라고합니다. 대조적으로, 나머지 3 개는 에너지를 감소 시켰으며이를 t2g 궤도라고합니다.
빛의 흡수
전자가 현재 점유하는 상태와 이용 가능한 다른 상태의 에너지의 차이와 동등한 에너지를 갖는 경우, 광자 광은 배위 착체에 의해 흡수 될 것이다. 결과적으로, 황산구리 착물은 t2g와 오비탈 간의 에너지 차이와 동등한 에너지로 광자의 광자를 흡수 할 수있다. 이와 같이, 황산구리 착물에 대한 에너지 차이는 스펙트럼의 적색-오렌지 영역에서 광자에 대한 에너지 차이와 동일하다. 청색광이 투과되는 동안 적색광이 흡수되므로 황산구리가 청색으로 나타납니다.
물에 녹이기
황산구리가 물에 용해되면, 구리와 황산염이 해리된다. 이제 구리 이온은 8 개의 분자로 둘러싸인 팔면체 복합체를 형성합니다. 그러나이 새로운 복합물에서 t2g 오비탈과 예를 들어 오비탈 사이의 분할이 여전히 붉은 오렌지 빛을 흡수하고 파란색 솔루션을 볼 수 있기 때문에 그 효과는 여전히 거의 동일합니다.